integrantes⠆
Lourdes Domingues
Leonardo Martinez
Britney Chang
Elizabeth Pineda
Estructura atómica
Lourdes Domingues
Leonardo Martinez
Britney Chang
Elizabeth Pineda
Modelo Atómico de Democrito
es y su comporta miento a partir de razonamientos lógicos y principios filosóficos . este modelo es extraída de la obra teoría atómica del universo concebida por leucipo pero desarrollada por el filosofo Democrito.Estructura atómica
Democrito sabia que si divides una piedra por la mitad tendrás 2 mitades con esencial mente las las mismas propiedades , pero si sigues cortando la piedra en partes mas pequeñas eventual mente tendrás una pieza tan pequeña que seria indivisible . El llamo a estas pequeñas piezas de materia ``átomos``.
democrito desarrollo que la solidez de los materiales y objetos depende de la forma en la que se encuentra relacionados los átomo que lo componen . así ,los átomos del hierro son duros .los átomos del agua son suaves ,los átomos del viento son ligeros , etc.
limitaciones ⠆
solo representa al átomo como una partícula .
democrito desarrollo que la solidez de los materiales y objetos depende de la forma en la que se encuentra relacionados los átomo que lo componen . así ,los átomos del hierro son duros .los átomos del agua son suaves ,los átomos del viento son ligeros , etc.
limitaciones ⠆
solo representa al átomo como una partícula .
Modelo Atómico de Schrodinger``1926``
es un modelo cuántico no relativista . en este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico.
limitaciones ⠆
concebía originalmente los electrones como ondas de materia . así la ecuación se interpretaba como la ecuación ondulatoria que describía la revolución en el tiempo y el espacio de dicha
onda material . mas tarde max bohr propuso una interpretación probabilista de la función de ondas electrones concebidos como partículas cuasi puntuales cuya probabilidad de presencia en una terminada región .
concebía originalmente los electrones como ondas de materia . así la ecuación se interpretaba como la ecuación ondulatoria que describía la revolución en el tiempo y el espacio de dicha
onda material . mas tarde max bohr propuso una interpretación probabilista de la función de ondas electrones concebidos como partículas cuasi puntuales cuya probabilidad de presencia en una terminada región .
Modelo Atómico de Dalton
introduce la idea de la discontinuidad de la materia , es decir , esta es la primera teoría científica que considera que la materia esta dividida en átomos .
los postulados básicos de esta teoría atómica son ⠆
- la materia esta dividida en unas partículas indivisibles e inalterables , que se denominan átomos
- todos los átomos de un mismo elementos son idénticos entre si , presentan igual masa e iguales propiedades.
- los átomos de distintos elementos tienen distinta masa y distintas propiedades .
- los compuesto se forman cuando los átomos se unen entre si en una relación constante y sencilla.
se sabe que los átomos si pueden dividirse y alterarse . el modelo atómico de Dalton fue remplazado por el modelo atómico de thomson.
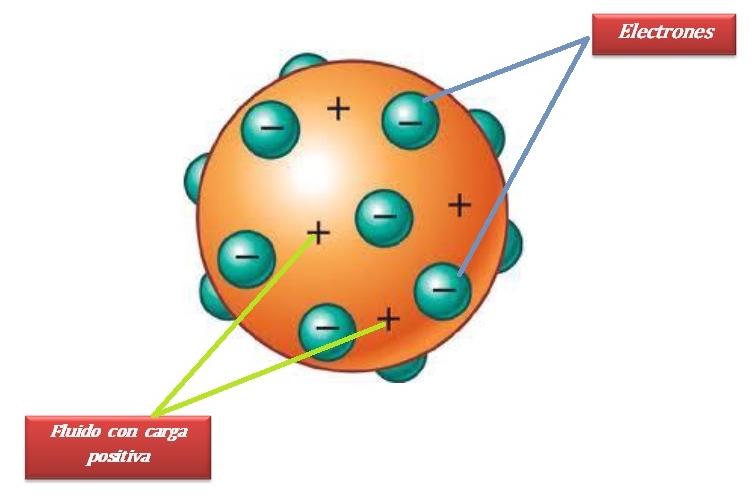
Modelo Atómico de thomson
introduce la idea de que el átomo puede dividirse en las llamadas partículas fundamentales
electrones ,con carga eléctrica negativa ,protones ,con carga eléctrica positiva .
thomson considera al átomo como una gran esfera con carga eléctrica positiva , en la cual se distribuyen los electrones como pequeños granitos .
limitaciones ⠆
el átomo no es macizo ni compacto como supone thomson , es práctica mente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo , según demostró E. Rutherford en sus experiencias .
-El átomo esta formado por dos regiones ⠆una corteza y un núcleo .
-En la corteza del átomo se encuentra los electrones girando a gran velocidad alrededor del núcleo .
-El núcleo es una región pequeña que se encuentra en el centro del átomo que posee la carga positiva .
-El núcleo posee la practica totalidad de la masa del átomo .
Limitaciones ⠆
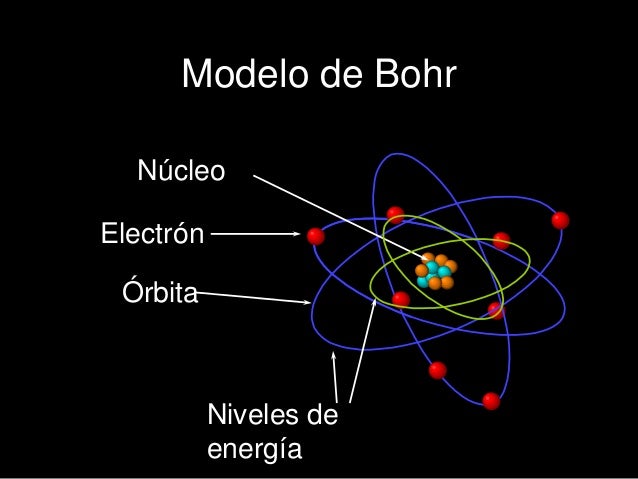
fue sustituida por el modelo atómico de Borh que daba una explicación a la estabilidad de las órbitas de los electrones y a los espectros de emisión característicos de cada elementos al calentarlos
Modelo Atómico de Rutherford
``1911´´Rutherford postulo lo siguiente-El átomo esta formado por dos regiones ⠆una corteza y un núcleo .
-En la corteza del átomo se encuentra los electrones girando a gran velocidad alrededor del núcleo .
-El núcleo es una región pequeña que se encuentra en el centro del átomo que posee la carga positiva .
-El núcleo posee la practica totalidad de la masa del átomo .
Limitaciones ⠆
fue sustituida por el modelo atómico de Borh que daba una explicación a la estabilidad de las órbitas de los electrones y a los espectros de emisión característicos de cada elementos al calentarlos
Bibliografia⠆
wikipedia
trabajotatimica.blogspot.com