Modelo atómico de Thomson
En dicho modelo ,el átomo esta compuesta por electrones de carga negativa en un átomo positivo ,como pasa en un puding se pensaba que los electrones se distribuían
uniformemente alrededor del átomo
Diseño Atómico de Thomson
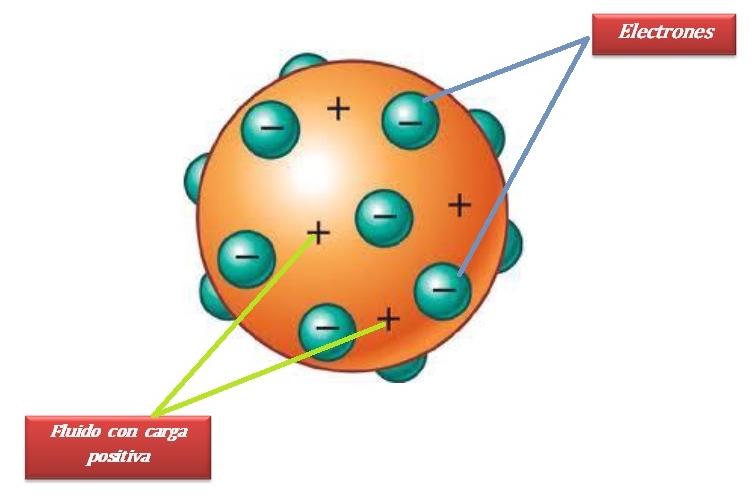
según el modelo de thomson el átomo consistía en una esfera uniforme de materia cargada positiva mente en la que se hallaban incrustadas los electrones de un modo parecido a como lo están las semillas en una sandia
Las Limitaciones
según el modelo de thomson ,los átomos están constituidas por una distribución de carga y masa regular ,y estos están unidos unos con otro formando la sustancia . Es decir ,la sustancia debería poseer ,una estructura interna homogénea y , por tanto , las partículas al atravesar deberían tener un comportamiento uniforme. tras los experimentos de Rutherford , y tras el descubrimiento de las partículas subatomicas se vio lo dicho por Thomson nose cumple
Modelo Atómico de Dalton
fue el primer intento completo para describir toda la materia en términos de los átomos y su propiedades . Dalton baso su teoría en la ley de la conservación de la masa y la ley de la composición constante
-la primera parte de su teoría establece que toda la materia esta hecha de átomos que son indivisibles .
-la segunda parte de su teoría establece que todos los átomos de un elemento dada son identicos en masa y propiedades .
-la tercera parte de su teoría establece que los compuestos son combinaciones de dos o mas tipos de diferentes átomos .
-la cuarta parte de su teoría establece que una reacción química es un re ordenamiento de átomos.
Diseño atómico de Dalton
 la materia esta formado por partículas muy pequeñas llamadas átomos . que son indivisibles y no se pueden destruir
la materia esta formado por partículas muy pequeñas llamadas átomos . que son indivisibles y no se pueden destruir
Limitaciones
La materia está formada por átomos que son partículas diminutas que no se pueden dividir, también postula que los elementos están formados por átomos iguales y los compuestos están formados por combinaciones de átomos.
Esta teoría es deficiente porque los átomos si se pueden dividir y ademas los átomos de un mismo elemento pueden ser diferentes.
Modelo Atómico de Bohr
El modelo átomo del físico Danes Niels Bohr es un modelo clásico del átomo en el que introduce una cuantizaciones a partir de ciertos postulados
-primera los electrones describen órbitas circulares en forma al núcleo del átomo , es de momento sin irradiar energía.
-segunda las únicas órbitas permitidas para un electrón son aquellas para las cuales el momento angular ,L, del electrón se a un múltiplo entero .
-tercera el electrón solo emite o absorbe energía en los saltos de una órbita permitida a otro.
Diseño Atómico de Bohr
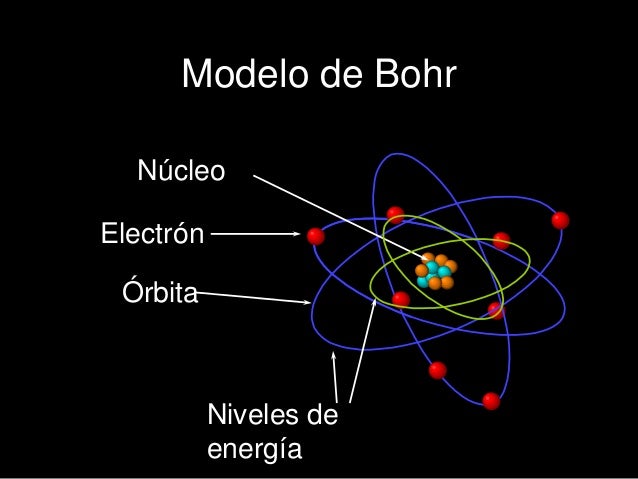 Bohr descubrió el átomo de hidrógeno con un patrón en el núcleo girando a su alrededor un electrón .
Bohr descubrió el átomo de hidrógeno con un patrón en el núcleo girando a su alrededor un electrón . Limitaciones
-Suponer que los electrones están en órbitas establecidas.Con el tiempo se encontró que no se puede determinar con tanta precisión la ubicación de las partículas (Principio de Incertidumbre de Heisenberg), por lo tanto, los electrones no están en órbitas fijas, sino que se encuentran en ciertas regiones, denominadas orbitales.
Modelo atómico de Rutherfold
El modelo atómico de Rutherford1 es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford2 para explicar los resultados de su «experimento de la lámina de oro», realizado en 1911.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
Diseño Atómico de Rutherfold
masa del atomo . los electrones giran a grandes
distancias alrededor del nucleo en orbitas
círculos
Limitaciones
